Last update: 2000/06/10
ホビイストのための、「家庭で作るプレパラート」。
私の経験にもとづく初心者向け解説、ゼリーの利用(実験中)、スンプ法など。
封入剤についての詳しいファイルは別にあります。
顕微鏡で観察したり写真をとるには、「プレパラート」を作る必要があります。と言ってもこれなら簡単。
材料に水を一滴たらし、カバーグラスをかければ出来上がり(「水で封じる」といいます)。非常にお手軽ですが、じきに乾いてしまい、いつまでも保存できません。こういうものを「一時プレパラート」といいます。うまくマニキュアなどで保護すると数日程度は持ちます。
「プランクトンウォッチング」5章には、カバーグラスをかける方法など、詳しくノウハウが出ています。こうした情報が具体的に解説されているのは珍しいので、初心者はぜひ一回見ることをすすめます。ここでは1点だけ。
気泡が入ると見にくいので、カバーはていねいにかけます。
材料は、生または固定(腐らないようにアルコール等で殺して保存)したものを、そのまま、または染色液で染めてみます。固定や染色の方法は、それこそ千差万別なので、またそのうち。なお、一時プレパラートでも水じゃない液で封じることもあります。
いろいろあるようですが、よくやるのは、メチルセルロースを使うやり方です。 試料(の入った水)をスライドグラスにとって、そこにメチルセルロースの粉をようじの先に少々つけてかきまぜると水が粘ってきて、ゾウリムシなどが動けなくなる、という方法です。「少々」とかいいかげんな感じですが、要は見やすくなればいいので、いろいろやって見てください。
ゼリーの利用もなかなか良好です。メチルセルロースと違ってスーパーでも売っていますし、方法も難しくないので、一度お試しください。
塩化ニッケルで麻酔する、という方法もよく聞きますが、濃度などの調節が難しいようです。

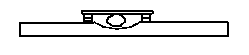
←坂田氏の本から描いた図
「ミジンコ道楽」p.101に、坂田氏が専門家の鷲塚淑子氏から教わった方法として、上図のようにホールグラスを使う方法が紹介されています。ビニールテープなどで隙間の間隔を調節するあたりがミソとのことですが、私はまだ試していません。
目的は違いますが、似た方法が「顕微鏡標本の作り方」(田中克己、裳華房1954)p.252に「懸滴標本」として紹介されています。この隙間に流動パラフィンを入れるのもよいとのこと。
いつでもゆっくり見られていいのですが、生きている状態をそのまま保存することは困難です。固定のしかたや封入剤、それに材料でいろいろですが、たいていは色や形が変化します。また、固定はうまくいっていても、ウニの胚など、柔らかく大きいものは封入の際に崩れてしまいます。やはりまず生の材料をよく観察し、スケッチや写真で記録しておく必要があります。
「永久プレパラート」には、大きくわけると
の2種類があります。それぞれ、本当にどの位もつのか、不明です。
樹脂封入なら、数十年?(根拠不明)。水溶性の封入剤のほうは、樹脂に比べると保存性が悪いようですが、それでもうまくいけば数年から十数年は問題ないようです。どちらの場合も、扱いが悪いと結構いたむようなので注意。封入のやり直しも、ある程度は可能(な場合もある)。
普通「永久プレパラート」というと有機溶媒に溶かした樹脂で封入するのが一般的です。でも、これは「材料をパラフィンに埋めてミクロトームで切って二重染色して・・・」というようなことをしている場合の話で、その辺の材料をプレパラートにしてちょっと保存しておきたい、なんていう時には面倒すぎます。材料の中の水分を徐々に有機溶媒に置き換えていくため、何段階ものステップが必要です。材料によっては簡略化してできないことはなですが、個人とか高校レベルでは、あまり普通やりません。
私がお手軽な方法として良いと思うのは水溶性の封入剤です。スライドグラスに材料を置いて、水の代わりにこれを使って封じるだけです。いろいろな封入剤があるのですが、取り扱いのしやすさでは抱水クロラールを使った各種の処方がいいような感じがします。時間はかかりますが、結構しっかりした感じに固まります。細胞が透明になるのが特徴で、材料によっていろいろな処方が使われています。志賀昆虫普及社から昆虫用の液が発売されているので一般の方にも入手しやすいと思います。
ただ、プランクトンのように材料が液の中に浮遊しているような場合は、この液はあまり適さない感じです(材料が液の周辺に逃げていく)。一時プレパラートをまず作って、そのカバーグラスの端からグリセリン系の液を1滴落し、カバーのまわりをシールして保存する方法が藻類の図鑑に紹介されています。しかしこの方法も、材料によっては細胞の形がくずれたりしてうまくいかないことがあります。
もう一つの系統の水溶性封入剤としては、グリセリン・ゼリーがあります。これは使用前に温めてゼリーを溶かしてやる必要があるのが面倒ですが、これを逆手に取って、後述のようにして使うこともできます。
このほか、それこそ様々な水溶性封入剤があるので、研究してみてください。
水で封じた場合、すぐに乾いてきてダメになりますが、このようにすると、何時間も放置しておけますので、ゆっくり観察できます。
動物プランクトンなどの動きも、だんだん鈍くなって、とても見やすくなります。
ゼラチンや寒天を溶かすのには電子レンジがとっても便利です。ふきこぼれない様に注意。
ゼリーの濃度の最適値はまだ不明です。ゼラチン2.5%(水だけ)で試したところ、せいぜい二日程度で気泡が入ってきて、ダメになりました。寒天1%+砂糖10%の場合、少なくとも1週間程度は大丈夫です。砂糖の影響?
グリセリンが手に入るなら、グリセリンゼリーを作るのがいいかも。
グリセリンゼリーの処方では、フェノールを防腐剤として入れていますが、このゼリーを使うと細胞はすぐに動かなくなります。これが良い場合も悪い場合もあると思います。しかし、どちらにしてもフェノールは家庭ではあまり使いたくはない薬ですので、うがい薬などを代わりに使うのがよいと思います(量は不明)。これなら使う時に台所の電子レンジで溶かしても、それほど問題ないでしょう。
「スンプ」とは"SUMP"で、Suzuki's Universal Micro Printing (鈴木式万能顕微印画法)の頭文字を取ったものだそうです。商標かどうかは不明。
セルロイド板を酢酸アミルで柔らかくして型をとり、その板をボール紙の台紙に固定して検鏡するのがオリジナル。そのままでは光を通さないもの、薄くすることができない(むずかしい)ものを観察する時に使います。
現在でもセットが売られていると思いますが、「セメダインC」で同じ事ができます。これは「接着レプリカ法」というんだそうです(「顕微鏡観察の基本」井上勤(監)地人書院 1998)。
材料になるべく薄く塗りつけて、よく乾かしてはがします(はがすのがなかなか大変なことがあるので、そのときはセロテープなどでくっつけてはがし、そのテープごとスライドに張りつける)。それを検鏡します。水などで封じると屈折率の関係で見にくくなります。そのまま見るか、カバーをかけて端をテープなどでとめるとかしましょう。「エアーマウント」っていうやつですね(?)。
毛などの場合、セメダインを塗り付けたあと乾く前にスライドグラスにはりつけます。余分な液をこすりとったあとよく乾かし、毛をはがしてスライドグラスをそのまま検鏡すれば「キューティクル」なんかも見えます。
公開: 1999/01/03
実は…、
4. 放置しておくと永久プレパラートに!?
という希望的観測というか、実にどうもお気楽なことを考えているのですが、はたしてうまくいくでしょうか?
まあ、あるていどは見通しがあるのです。花粉管の観察は上のような感じでやります。で、花粉をまいて、花粉管がのびて、最後にカバーをかけて観察したまま片づけを忘れてたやつを何ヶ月かぶりに見つけたのです。これがちゃんと見えるのです。
2000/06/10 その後あまり追求してませんが、とりあえずそんな甘いものではない、みたい。